2. 南京信息工程大学大气科学学院,南京 210044;
3. 南京信息工程大学应用气象学院,南京 210044;
4. 兰州中心气象台,兰州 730020
2. School of Atmospheric Science, Nanjing University of Information Science and Technology, Nanjing 210044;
3. School of Applied Meteorology, Nanjing University of Information Science and Technology, Nanjing 210044;
4. Lanzhou Central Meteorological Observatory, Lanzhou 730020
人类健康与天气变化存在一定联系,近年来,随着全球气候变暖带来的极端异常天气多发,不仅给社会经济带来损失,也危害着人体健康(张书余等,2012),因此受到越来越多的组织和机构的关注。流行病学研究和统计学研究都已证实,高温热浪发生时,冠心病发病率明显增加,每次热浪期间都会有大量人群因热暴露而入院或者死亡(田颖等,2013; 闵晶晶等,2014)。Kunst等(1993)通过研究1979-1987年间极端天气与死亡的关系,发现在热浪引起的死亡中,26%是由心血管疾病引起。近10年来, 中国心脑血管病发病率、死亡率和危险因素仍呈直线上升趋势。心脑血管病构成我国40.72%的死亡(唐朝枢, 2006)。陆晨等(2003)发现,高温天气期间,心脑血管疾病就诊率占总就诊人数的35.1%,其中冠心病就诊率达10.8%。中国卫生部心血管病防治研究中心(2010)指出目前我国约有2.3亿人患冠心病、心力衰竭、高血压等心血管疾病,每年因心脑血管疾病死亡的人数近300万,而且该病的发病和死亡率仍呈增长趋势。可见热浪对心血管疾病患病人群有明显的影响。但是,高温热浪对心血管疾病的影响机制还没有得到合理的解释。
冠心病即冠状动脉粥样硬化型心脏病,大多是由于冠状动脉发生动脉粥样硬化、粥样硬化斑块堆积甚至堵塞血管内壁而发生狭窄,引起心脏供血供氧不足而引发一系列心脏不适症状的一类心血管疾病。动脉血管粥样硬化病变的病理过程一般从内皮损伤开始,并可能与机体内多种细胞因子的活动相关。已有研究发现,氧化应激和炎症反应可能参与了冠心病等心血管疾病的发生发展,而极端高温天气对机体生理指标、内皮标志物、炎性因子等影响的研究极少。高温热浪引起冠心病事件发生的机制与以上指标在高温刺激下的变化有关,已患有动脉粥样硬化的群体及血管功能下降的老年群体更是高危人群。
目前,国内气象系统已开展了疾病的专业气象预警预报,但这些预报大多较笼统,所用的医学指标多来源于流行病学方面的统计数据,并不能准确地对热浪的危害做出预警。为了科学地预防和降低热浪对人类健康的影响,目前迫切需要加强热浪引发和加重心血管疾病的机制研究。本研究利用张书余等(2013)同样的实验手段(张夏琨等,2014),选择动脉粥样硬化模型鼠作为研究对象,收集并模拟了一次实际的热浪过程,通过对实验动物的热刺激,分析相关指标以揭示热浪对冠心病的影响机理,为今后深入开展冠心病等心血管疾病气象预警及疾病预防工作奠定基础。
1 材料与方法 1.1 实验仪器和材料TEM1880气象环境模拟箱,可以提供温、湿、压联合实验环境,温度可控于-30~120℃,波动范围±0.5℃,湿度可控范围为30%~98%,波动度为±3%RH(≥75%RH),±0.5%RH(<75%RH),根据实验需求和基本功能,实验箱可提供高、低温、湿热联合实验环境,同时保证实验过程中有新鲜空气补入,以满足实验动物的正常呼吸需求。
水合氯醛、四氢生物蝶呤(BH4)、血管内皮素(ET-1) ELISA试剂盒、一氧化氮(NO)硝酸还原酶法试剂盒、总超氧化物歧化酶(T-SOD)羟胺法试剂盒、细胞间黏附因子(s-ICAM)ELISA试剂盒、热应激蛋白60(HSP60) ELISA试剂盒、肿瘤坏死因子(TNF)ELISA试剂盒。
1.2 热浪实验曲线收集南京2001-2010年6-8月的逐时气象要素数据。热浪的标准根据中国气象局规定及华东地区相关研究拟定,将日最高温度≥35℃称为高温日,连续3 d及以上的高温天气过程称为热浪(黄卓等,2011)。许遐祯等(2011)对南京热浪研究发现,热浪的持续时间对人体的影响很小,另外考虑到动物的耐热性,本文选取2001年7月9-11日一次南京持续时长为3 d的实际热浪过程进行实验研究,实验模拟温度曲线如图 1所示。对照组实验温度选取为27℃。
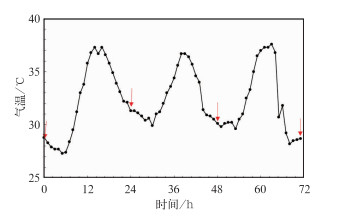
|
图 1 热浪实验温度曲线 (箭头所指为实验模拟组小鼠体温体重采样点,对照组采样为同时间点) Fig. 1 Temperature curve of simulated heat wave (The arrows stand for sampling time points when body temperature and body weight of experimental rats were measured in the three experimental groups) |
实验对象选用18只8周龄雄性SPF级动脉粥样硬化模型小鼠,对小鼠采用高脂膳食(10%猪油、10%胆固醇、2%胆盐,其余为基础饲料)适应性饲养8周,进行动脉粥样硬化模型的建立(白慧称等,2010)。实验小鼠由北京维通利华实验动物技术有限公司提供,许可证编号SCXK(京)2011-2012,高脂饲料购自北京科澳协力有限公司。
饲养环境噪音控制在60 dB(A)以下,昼夜光照节律12 h/12 h(每日光照时间08:00-20:00),实验室温度27℃,此温度为10年间南京夏季的平均温度。给予小鼠充足的饲料和水,垫料是胶囊状玉米芯,并每日进行实验鼠垫料的更换。每日对小鼠进行捉拿训练以减少实验过程中捉拿带来的额外影响。
依据体重大小将18只小鼠分配至6个区组,每个区组3只,再将3只小鼠随机分配到对照组、热浪组、热浪四氢生物蝶呤(Tetrahydrobiopterin, BH4) 组中,每组共有6只小鼠。其中,BH4作为稳定的内皮源信使以及NO的合酶,可以影响到冠状动脉血管的病理学扩张(张华等,2005),添加BH4组有助于探讨热浪对动物机体反应的影响。
1.4 实验过程实验前对所有小鼠进行8周高脂膳食适应性空白对照饲养,食物与水保持充足,动物饲养室内,光照节律12 h/12 h(08:00-20:00),室温和相对湿度分别控制在27℃和45%。并在最后一天对热浪BH4组小鼠进行BH4药物灌胃,剂量为10 mg·kg-1,其余组小鼠给予生理盐水。空白对照饲养后,按照上述方法对各组小鼠进行分组,依照热浪模型设置气象环境模拟箱内的温度变化过程,将热浪组及热浪BH4组放入人工气象环境模拟箱,暴露于热浪过程,接受高温刺激。对照组饲养条件同空白对照适应期。期间,各组小鼠可自由摄食及饮水,气候箱内光照节律仍控制为12 h/12 h(08:00-20:00)。
1.5 指标监测与收集整个热浪过程持续72 h,过程中逐日观察小鼠状况并测量体重、肛温,对热浪BH4组进行药物灌胃。采样时间点如图 1箭头所示;模拟过程结束后,利用腹腔注射水合氯醛溶液[7%水合氯醛,0.3 ml·(100 g)-1]将各组实验小鼠麻醉后,利用手术器械进行断头采血。所采血样进行3000 rpm×10 min离心,分离血浆并储存于-20℃低温冰箱待检。另外,摘取小鼠心脏,取心尖部称重,并加入9倍0.9%生理盐水进行匀浆,于3000 r离心15 min,取上清液于-20℃存储待检。
测定前,将血浆冻品在37℃条件下进行解冻,利用ELISA试剂盒和酶标仪对血浆ET-1、sICAM-1以及TNF进行处理和测定,利用硝酸还原酶法对血浆NO进行测定。同理,将小鼠心肌组织液冻品复溶,利用羟胺法测定心肌组织SOD活性,用ELISA法对心脏sICAM-1、HSP60的含量进行测定。
1.6 统计分析利用SPSS19.0软件建立数据库并对所有指标数据进行统计分析和处理,计量数据均以均数±标准差(x±s)表示,2组间比较采用独立样本t检验。当P<0.05,即为差异具有统计学意义。
2 实验结果分析 2.1 体重与肛温逐日3 d监测实验小鼠体重、肛温变化。如图 2所示,各组小鼠在实验前后体重稍有增加(P>0.05);随着热浪过程的发生发展,各组小鼠肛温均呈上升趋势。其中,实验前后热浪组升高0.7℃,热浪BH4组升高0.2℃,对照组升高0.1℃,热浪组与对照组相比肛温升高的差异较明显(P<0.01),热浪BH4组和对照组差异没有统计学意义(P>0.05)。
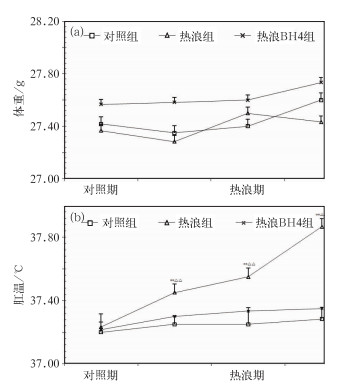
|
图 2 对照组与热浪组(热浪暴露期为3 d)小鼠体重(a)和肛温(b)变化图 (**P<0.01与对照组相比;△△P<0.01与同期热浪BH4组相比) Fig. 2 Body weight (a) and rectal temperature (b) of heart disease rats (** P < 0.01 vs. control group; △△ P < 0.01 vs. heat wave BH4 group at time of measurement) |
超氧化物歧化酶(superoxidedismutase, SOD)作为心脏病诊断的一个敏感指标, 它的性征在许多心脑血管疾病发病早期就产生变化, 与冠心病密切相关。由图 3可见,与对照组相比,热浪刺激使得热浪组小鼠心脏组织中的SOD活性明显下降(P<0.01),下降了37.75 U/mgprot。BH4组SOD活力也有所减低,但是差异不具有统计学意义(P>0.05);热浪组与BH4组相比SOD活性也低,差异显著(P<0.01)。由此可知,冠心病小鼠热暴露3 d可使它心脏组织的SOD活力下降,而BH4可以缓解热浪对冠心病小鼠SOD活力下降的影响。
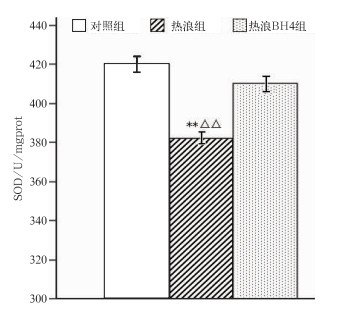
|
图 3 冠心病小鼠心脏组织SOD实验结果分析图 (说明同图 2) Fig. 3 SOD activity in heart disease rats at the end of the Note experiment (same as Fig. 2) |
心脏组织SOD活力下降,可导致心脏组织氧自由基过多,脂质过氧化反应加剧,造成内皮细胞和心功能损伤,引起心肌缺血;同时,产生的大量活性氧(ROS)会直接损伤血管内皮细胞,使得NO灭活,并氧化血液中的脂蛋白,使胆固醇沉积在血管壁上,形成动脉粥样硬化(胡平等,2009)。陈瑗等(2008)指出氧化损伤是冠状动脉硬化形成的一个重要机制,SOD减少越多说明氧化损伤愈严重,脂质代谢愈紊乱。由此分析表明,高温热浪可导致冠心病患者心脏组织SOD活性下降(Wang et al,2014),使氧化血液中的脂蛋白加剧,加速胆固醇在血管壁上的沉积,形成动脉粥样硬化,致使冠心病病情加重。
2.3 ET-1、NO及ET-1/NO的变化血管内皮素1(ET-1) 是由血管内皮细胞和心肌细胞分泌的一类多功能生物活性多肽,是目前已知最强烈的血管收缩因子(甘富东等,2010)。内皮源性的一氧化氮(NO)是机体内主要的血管舒张因子,可促进血管平滑肌舒张,使得血管扩张。所以,ET-1与NO作为调节动物体内血管收缩平衡及心血管功能的重要因子,在冠心病病理机制研究中有重要地位(李振乾等,2008)。两者的比值可以反映血管舒张水平。
由图 4a可以看到,冠心病小鼠在实验前后各组鼠体内的ET-1水平没有任何影响,不具有统计学差异(P>0.05);图 4b为小鼠体内NO的变化,小鼠的热浪组和热浪BH4组相对于对照组差异显著(P<0.01),其中热浪组NO水平较对照组高出10.36 μmol·L-1,热浪BH4组的NO水平高于热浪组(P<0.05),显著上升,其值为34.46 μmol·L-1;图 4c显示的是NO与ET-1之间的比值情况,可以看到,其整体变化趋势与NO相似,小鼠的热浪组与热浪BH4组其比值相于对照组有明显的上升(P<0.01),热浪BH4组与对照组及热浪组差异显著(P<0.01),具有统计学意义。热浪组相对于对照组,比值虽有上升但不具有统计学差异(P>0.05)。
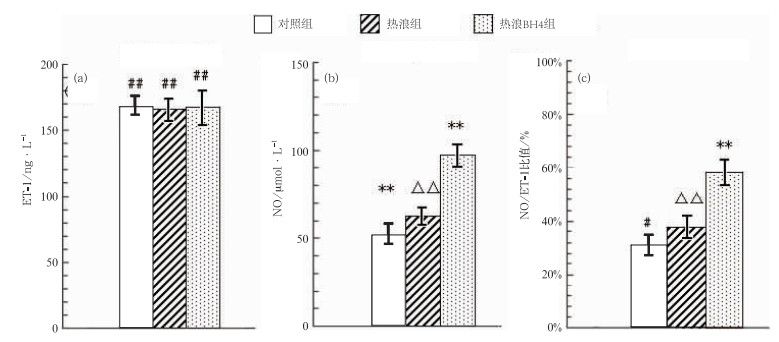
|
图 4 冠心病小鼠ET-1(a)、NO(b)以及NO/ET-1比值(c)的结果对比图 (**P<0.01与对照组相比;##P>0.05实验前后各组鼠体内的ET-1相比;△△P<0.01与同期热浪BH4组相比;#P>0.05NO/ET-1的热浪组与对照组相比) Fig. 4 ET-1 level (a), NO level (b), and NO/ET-1 ratio (c) in heart disease rats at the end of the experiment (##P > 0.05 vs. ET-1 level before the experiment; **P < 0.01 vs. control group; △△P < 0.01 vs. heat wave BH4 group; #P > 0.05 vs. control group) |
上述分析表明,热浪刺激对小鼠ET-1水平没有影响,高温热浪使NO明显增加,使得NO/ET-1平衡偏向血管扩张一侧,增强机体散热,促进体温下降。随着热浪过程的发生发展,冠心病小鼠内皮释放的NO不足以缓解热浪的影响,使得小鼠体温随着热浪影响的时间增加上升幅度愈明显。实验结果表明,BH4作为一种NOS合酶,它可以增加冠心病小鼠体内释放的NO水平,增强机体散热效率,降低热浪对冠心病小鼠的危害。
2.4 HSP60变化分析热休克蛋白(HSPs)也称热应激蛋白。研究表明,高温热浪可使机体免疫功能下降并产生热应激反应,使得体内HSPs水平上升,促进免疫调节,从而对热环境达到适应(熊一力等,1995;李亚洁等,2004;张志辉等,2006;马玉红等,2002)。HSP家族与自身免疫性疾病、动脉粥样硬化等疾病的发生发展有密切关系。HSP60是HSP家族中的重要一员,
周吴刚等(2007)发现冠心病患者血清HSP60水平与冠脉病变程度相关,Zhang等(2008)提出HSP60的表达水平与冠心病发病风险极为相关,高表达群体的患病风险可高出数倍。李小林等(2009)通过小鼠实验得出,口服HSP60可能通过扩增调节性T细胞而诱导机体产生抗原特异性免疫耐受,从而抑制动脉粥样硬化形成。可见HSP60与冠心病的形成与发展存在联系。本次实验通过模拟热浪刺激,观察小鼠在持续性高温后体内HSP60变化,并探讨其在冠心病发病过程中可能产生的作用。
从各组小鼠心肌组织中HSP60的实验结果(表 1)看出,热浪组、BH4组的HSP60与对照组比较均有增加,其中热浪组小鼠HSP60含量显著高于对照组(P<0.05),高出1.43 ng·ml-1,而BH4组上升幅度较小(P>0.05),仅高于对照组0.25 ng·ml-1,并显著低于热浪组水平(P<0.05)。由此可见,热浪可诱导冠心病小鼠心肌组织HSP60含量明显增加。王贺等(2012)、杨军等(2011)研究指出机体在热刺激下产生的过多的HSP60可以活化免疫细胞,诱导内皮细胞、巨噬细胞分泌大量ICAM-1、TNF-α等炎性细胞因子,通过引起机体免疫应答,使得巨噬细胞、平滑肌细胞表面的HSP60及其抗体结合、产生抗体复合物,损伤内皮,增加炎性细胞粘附及脂质沉积,从而形成动脉粥样硬化。动物和人体粥样硬化斑块中均发现有HSP60的高度表达(Mandal et al,2004)。阻断HSP60引起的免疫反应可能成为防治动脉粥样硬化的有效途径(王成章等,2007)。因此热浪可使小鼠心脏组织中HSP60的表达水平升高,促进炎性因子表达上升及炎症细胞聚集,加速动脉粥样硬化,导致冠心病病情加重。BH4可增加机体散热,减轻热应激反应,使HSP60表达水平下降,从而对机体产生保护作用。
|
|
表 1 冠心病小鼠HSP60和HIF-1α实验结果分析 Table 1 HSP60 level and HIF-1α level in coronary heart disease rats at the end of the experiment |
越来越多的研究表明,动脉粥样硬化可能是一种炎症性疾病,在动脉硬化早期形成及发展过程中有着关键作用。细胞因子是机体主要的炎症介质,其中肿瘤坏死因子(TNF)是具有全身效应的细胞因子,它的两种形式TNF-α和TNF-β,炎症活性相似(王文生,2004),可参与机体的炎症反应,引起心肌细胞损伤,与心肌缺血程度及冠心病等心血管疾病的发生密切相关。另外,TNF-α等细胞因子还可诱使黏附分子(ICAM-1) 表达增加(申文祥, 2007)。炎症的发生正是始于白细胞与血管内皮间的黏附作用,在ICAM的介导下,白细胞、血小板可实现黏附聚集,炎症细胞会黏附于血管内皮,并渗透到内皮细胞下分泌细胞活性物质,导致血管平滑肌细胞增生、形成泡沫细胞,造成动脉粥样硬化形成及发展(林昌勇,2011;张宏等,2004)。所以,TNF和ICAM-1可能标志着机体炎症反应程度,是冠心病的独立危险因子(李斌等,1996;彭锐等, 2010;王文清等, 2012)。检测两者血浆水平为冠心病发病机制的进一步研究提供了依据。
细胞因子与机体热应激、热适应密切相关(李敏,1998)。持续性高强度的热刺激可能导致机体过热,TNF等细胞因子表达显著上升,引发炎症损伤(陈忠等,1997)。由表 2可见,热浪组小鼠TNF水平较对照组显著上升(P<0.01),增幅可达1.19 pg·ml-1。BH4的作用使得BH4组小鼠体内TNF水平的变化幅度得到减缓,与对照组相比,BH4组TNF水平稍有上升,为0.36 pg·ml-1,组间差异不显著(P>0.05),而BH4组小鼠TNF水平显著低于热浪组(P<0.05),差值为0.83 pg·ml-1。因此热浪可使机体TNF水平升高,导致冠心病发病或病情加重。它是热浪引发冠心病发病的机制之一。
|
|
表 2 冠心病小鼠TNF和sICAM-1实验结果分析 Table 2 TNF level and sICAM-1 level in coronary heart disease rats at the end of the experiment |
热浪可通过诱导机体TNF表达水平增加,加大小鼠冠心病风险的主要机制为(蒋国新,2009;向萍霞,2005;Valgimigli et al,2004;梁伟钧等,2003):(1) 激活体内炎症系统,通过调节细胞黏附因子等多种细胞因子和炎性介质,加重动脉粥样硬化斑块的炎性反应,促进动脉粥样硬化的形成和发展;(2) 破坏内皮细胞结构,使其通透性增高,增加血中胆固醇穿透内膜在血管内壁的沉积。内皮与血管通透性、机体免疫、炎症反应等生理反应有密切关系,在心肌缺血等心脑血管类疾病等多种疾病的研究中占优重要地位,内皮细胞和平滑肌细胞上TNF-α的表达可以贯穿于早期的内膜增厚直到形成阻塞性斑块的过程中(张君怡, 2008)。(3) 损伤血管、心肌结构,破坏心脏功能。研究证实,TNF-α在病理情况下可持续大量产生,并在心肌组织累积(Hirschl et al,1996)。TNF-α过多,可破坏心肌细胞内钙平衡(Hirschl et al,1996)、影响LPS(脂多糖)水平(Stamm et al, 2001),导致心肌受损、心脏功能衰减;也可通过促中性粒细胞黏附、侵润和活化,促进活性氧及蛋白水解酶释放等途径迫害心肌组织与功能(王文生,2004)。周亚峰等(2004)也发现,高浓度的TNF-α可促进心肌和血管内皮细胞凋亡,这种破坏作用随TNF-α的作用时间和浓度的增加而加剧。(4) 诱导ICAM-1、血栓素等血管活性物增加,造成血粘度增加,促进原癌基因转录,产生血小板源性生长因子,促进血小板凝集,破坏血凝与抗血凝平衡,利于血栓的形成。(5) 抑制脂蛋白酯酶活性,加速肝脏脂肪酸合成,使得脂质过氧化反应加强,诱导脂质浸润血管内膜,形成动脉硬化斑块,同时控制巨噬细胞的胆固醇代谢,利于脂质物质沉积于血管壁而增加冠脉疾病风险。
ICAM是一类具有调节细胞与细胞或细胞与细胞外基质相互识别、黏附及信号传递作用功能的糖蛋白分子,广泛分布于体内,参与机体炎症与免疫应答、凝血及血栓形成等多种生理病理过程(申文祥,2007;徐延光,2005;薛艳军,2008)。研究表明,血中sICAM-1可反映冠脉炎症反应的程度(徐延光,2005),在内皮细胞与白细胞、血小板之间的细胞黏附作用中发挥着关键作用,sICAM-1表达升高后,可通过诱导白细胞黏附于血管内皮,形成血栓,同时,介导的激活白细胞所产生的氧自由基和血管活性物质可引起内皮损伤;可介导单核细胞与内皮黏附,影响机体脂质代谢(林昌勇,2011;刘广燕, 2009);可介导中性粒细胞与单核细胞相互黏附,释放颗粒物,从而易引起血管堵塞,所以sICAM-1与动脉粥样硬化及冠心病的发生发展密切相关(林昌勇,2011)。Luc等(2003)对300多名冠心病患者跟踪5年观察发现,血浆sICAM-1水平升高与心绞痛、心梗等疾病的发生及死亡事件相关。sICAM-1每升高100 ng·ml-1,冠脉事件风险将增加30%(刘晓利,2005)。所以,高温热浪使得体内炎症反应加强,其浓度的变化对冠心病的发生发展及预后有一定的参考意义。
如表 2所示,热浪可诱使冠心病小鼠机体sICAM-1水平显著增加,而BH4可以缓解该影响。模拟过程结束时,与对照组相比,热浪组小鼠血浆sICAM-1表达水平显著上升(P<0.05),比对照组高出18.43 pg·ml-1;热浪BH4组小鼠sICAM-1水平比对照组稍有增加,为2.35 pg·ml-1,差异不具有统计学意义(P>0.05)。热浪组sICAM-1表达水平显著高于BH4组(P<0.05),差值为16.08 pg·ml-1。本次实验证实,添加BH4药物组小鼠受到热浪影响较小,TNF、sICAM-1水平明显低于热浪组。Verma等(2002)通过大鼠离体心脏及体外培养的人心肌细胞实验发现,BH4有抑制冠脉内皮细胞功能衰退的作用,并可减少脂质过氧化物的产生,减少心肌细胞损害。BH4也可抑制血小板聚集及血小板选择素的表达(王文生,2004)。可见,BH4可缓解高温热浪刺激造成的机体炎症因子的表达增加,从而减缓炎症反应造成的内皮损伤与心肌损伤,改善心肌微循环,保护心血管系统。
2.6 HIF-1α的变化分析缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1) 是一种具有转录活性的核蛋白,与缺氧适应、炎症过程中的大量相关基因的表达相关,可上调红细胞生成素、血管内皮因子等多种靶基因的转录(刘奉君等, 2009)。Treinin等(2003)通过线虫实验证实,HIF-1α在热耐受性及热适应响应有着重要作用,可在热环境下被诱发,但是主要体现在热应激的初始阶段,对于热应激的耐受仅能起到短暂的作用,不足以应付长时间的热刺激或是极端高温。赵爱华(2011)指出HIF-1α的含量与冠心病疾病的发生及患者病情程度相关,HIF与冠心病等缺血性疾病发生发展可能存在密切关系。本次实验通过模拟热浪刺激对小鼠的影响,探讨热浪发生时动物机体内HIF含量的变化。
实验结果表明(表 1),热浪组冠心病小鼠体内HIF-1α含量与对照组相比明显增加,其上升值为74.34 pg·ml-1,同时,热浪BH4组小鼠心脏匀浆HIF-1α表达水平低于对照组和热浪组,其值分别为73.01和147.35 pg·ml-1。由此可知,热浪可诱导小鼠HIF-1α表达增加。HIF-1与机体炎症反应、血管新生相关,Cramer等(2003)通过体外骨髓细胞实验证实,HIF-1α是组织浸润的黏附、迁移等过程中的关键因素,缺失HIF-1α甚至可导致炎症反应受到抑制。Sluimer等(2008)证实,颈动脉粥样硬化斑块中确实存在缺氧及HIF-1α表达增加的现象,导致动脉粥样硬化进一步发展。而减少HIF-1α的表达可通过抑制血管新生和炎症反应,改善相关疾病的病情(周桃等,2007)。以上分析表明,热浪刺激可通过诱导心肌组织中HIF-1α的表达增加,增大冠心病发病风险,而补充BH4可以缓解热刺激造成的影响,对机体起到保护作用。
3 结论与讨论本次实验利用气象环境模拟箱模拟了南京一次实际热浪天气过程,通过测定冠心病小鼠在热浪过程前后ET-1、NO、HSP60、SOD、TNF、sICAM-1和HIF-1α的水平,同时对比给予BH4的小鼠以上各指标的变化情况,探讨了热浪天气对冠心病的影响及其机理和BH4在机体热应激中的保护作用。
3.1 热浪天气对各种与冠心病相关的生化指标的影响SOD是维持体内氧化平衡及血管内皮功能的重要指标。热浪刺激使得冠心病小鼠心肌组织SOD活性明显下降,BH4具有抗氧化作用,可缓解热浪对SOD活性的影响,外源性补充BH4、SOD等措施利于防治动脉粥样硬化发生及发展,减少高温热浪天气的危害;热浪刺激对小鼠ET-1水平没有任何影响,而NO明显增加,使得NO/ET-1平衡偏向血管扩张一侧,增强机体散热,促进体温下降。
随着热浪过程的发生发展,冠心病小鼠内皮释放的NO不足以缓解热浪的影响,使得小鼠体温随着热浪影响的时间增加上升幅度愈明显。BH4作为一种NOS合酶,实验结果表明,它可以增加冠心病小鼠体内释放的NO水平,增强机体散热效率,降低热浪对冠心病的影响;热浪可诱导冠心病小鼠心肌组织HSP60含量明显增加。BH4可增加机体散热,减轻热应激反应,从而降低HSP60含量,降低热浪对冠心病的影响;TNF和sICAM-1可表征机体炎症反应程度,热浪刺激诱使两者在机体的含量增加,促进动脉粥样硬化的形成,补充BH4可明显降低炎性指标水平;热浪刺激可使心肌组织中HIF-1α的表达增加,增大冠心病发病风险,而补充BH4可以缓解热刺激造成的影响,对机体起到保护作用。
3.2 热浪天气导致冠心病发生及加重的可能机理综合以上分析,热浪天气导致冠心病发生发展的可能机制是:热浪可诱导冠心病小鼠心肌组织HSP60含量明显增加,过多的HSP60可以活化免疫细胞,诱导内皮细胞、巨噬细胞分泌大量ICAM-1、TNF-α等炎性细胞因子,机体血浆中TNF-α和sICAM-1的增加。同时从5个方面影响冠心病的变化:(1) 激活体内炎症系统,通过调节细胞黏附因子等多种细胞因子和炎性介质,加重动脉粥样硬化斑块的炎性反应,HIF-1α表达增加,进一步加重了机体炎症反应,促进动脉粥样硬化的形成和发展。(2) 破坏内皮细胞结构,使血管内膜通透性增高,同时高温热浪使冠心病患者心脏组织SOD活性下降,导致心脏组织氧自由基过多,使氧化血液中的脂蛋白加剧,大量的胆固醇生成,加速胆固醇穿透内膜在血管内壁上的沉积,形成动脉粥样硬化,致使冠心病病情加重。(3) 损伤血管、心肌结构,破坏心脏功能。TNF-α在病理情况下可持续大量产生,并在心肌组织累积。过多TNF-α可破坏心肌细胞内钙平衡、影响脂多糖水平,高浓度的TNF-α可促进心肌和血管内皮细胞凋亡,这种破坏作用随TNF-α的作用时间和浓度的增加而加剧。(4) 诱导ICAM-1、血栓素等血管活性物增加,造成血粘度增加,促进原癌基因转录,产生血小板源性生长因子,促进血小板凝集,破坏血凝与抗血凝平衡,利于血栓的形成。(5) 抑制脂蛋白酯酶活性,加速肝脏脂肪酸合成,使得脂质过氧化反应加强,诱导脂质浸润血管内膜,形成动脉硬化斑块,同时控制巨噬细胞的胆固醇代谢,利于脂质物质沉积于血管壁而增加冠脉疾病风险。
3.3 讨论虽然本实验是高温热浪导致冠心病病情加重、甚至死亡的初步机理研究成果,更深入的研究有待进一步加强。但是,相关结论为我国高温热浪预警服务和冠心病防御等,提供了科学的理论依据。
白慧称, 李军, 刘敬浩, 等, 2010. 高脂膳食对小鼠生化及病理形态的影响[J]. 中国比较医学杂志, 20(1): 41-45. |
陈瑗, 周玫, 2008. 氧化应激-炎症在动脉粥样硬化发生发展中作用研究的新进展[J]. 中国动脉硬化杂志, 16(10): 757-762. |
陈忠, 朱剑琴, 1997. 高温中暑的病理生理学研究进展[J]. 国外医学:生理病理科学与临床分册, 17(4): 373-375. |
甘富东, 黄照河, 2010. ET, NO和TNF-α在冠心病发病中的关系探讨[J]. 现代中西医结合杂志, 19(18): 2223-2224. DOI:10.3969/j.issn.1008-8849.2010.18.006 |
黄卓, 陈辉, 田华, 2011. 高温热浪指标研究[J]. 气象, 37(3): 345-351. DOI:10.7519/j.issn.1000-0526.2011.03.013 |
胡平, 吴耿伟, 夏青, 等, 2009. SOD模拟及其抗氧化和抗炎症功能的研究进展[J]. 化学进展, 21(5): 873-879. |
蒋国新, 2009. 冠心病患者血清血管紧张素Ⅱ与NO, NOS及TNF-α的相关性研究[J]. 南通医学院学报, 29(6): 458-460. |
李斌, 陈为民, 1996. 冠心病和高血压老年患者血浆肿瘤坏死因子测定及其临床意义[J]. 福建医学院学报, 30(1): 36-38. |
李敏, 1998. 细胞因子与热应激和热适应[J]. 中华劳动卫生职业病杂志, 16(2): 120-122. |
李小林, 李大主, 王治, 2009. 热休克蛋白60口服耐受对小鼠动脉粥样硬化斑块的影响[J]. 中国免疫学杂志, 25(3): 206-208. |
李亚洁, 廖晓艳, 李利, 2004. 高温高湿环境热应激研究进展[J]. 护理研究, 18(9A): 1514-1517. |
李振乾, 赵安成, 2008. 冠心病患者血浆中CNP, ET, NO水平变化的临床研究[J]. 实用医技杂志, 15(8): 976-977. |
梁伟钧, 符益冰, 陈建英, 2003. 冠心病患者血浆内皮素和肿瘤坏死因子含量变化及其临床意义[J]. 心脏杂志, 15(2): 137-138. |
林昌勇, 2011. 冠心病病人血清IMA, sICAM与hs-CRP变化及其意义[M]. 青岛: 青岛大学.
|
刘奉君, 刘利民, 宋宏伟, 2009. 缺氧诱导因子-1基因多态性与疾病相关性研究进展[J]. 细胞与分子免疫学杂志, 25(11): 1070-1071. DOI:10.3321/j.issn:1007-8738.2009.11.037 |
刘广燕, 2009. 冠心病病人血清OXLDL与sICAM-1的变化及其临床意义[M]. 青岛: 青岛大学.
|
刘晓利, 2005. ICAM-1, IL-6的血浆水平及基因多态性与脑梗塞[M]. 北京: 中国协和医科大学.
|
陆晨, 李青春, 2003. 北京2002年夏季高温天气心脑血管疾病调查报告[J]. 中国气象学会2003年年会: 227. |
马玉红, 王征, 张宛玉, 等, 2002. 高温对老年小鼠腹腔巨噬细胞热休克蛋白及其它免疫指标表达的影响[J]. 中国老年学杂志, 22(5): 418-419. |
闵晶晶, 丁德平, 李津, 等, 2014. 北京急性脑血管疾病与气象要素的关系及预测[J]. 气象, 40(1): 108-113. DOI:10.7519/j.issn.1000-0526.2014.01.013 |
彭锐, 吴伟, 葛昕, 2010. 从炎症因子角度谈冠心病热毒病机[J]. 世界中西医结合杂志, 5(8): 732-735. |
申文祥, 2007. 可溶性细胞间黏附分子-1和可溶性血管细胞黏附分子-1与冠心病的相关性[M]. 郑州: 郑州大学.
|
唐朝枢, 2006. 心脑血管疾病发病和防治的基础研究[J]. 生命科学, 18(3): 199-208. |
田颖, 张书余, 罗斌, 等, 2013. 热浪对人体健康影响的研究进展[J]. 气象科技进展, 3(2): 49-54. |
王成章, 马丽苹, 2007. 热休克蛋白60与冠状动脉粥样硬化关系的研究进展[J]. 临床误诊误治, 20(12): 18-19. DOI:10.3969/j.issn.1002-3429.2007.12.013 |
王贺, 卢义. 2012. 热休克蛋白60与冠状动脉粥样硬化关系的研究进展中国实验诊断学, 16(4): 750-753.
|
王文清, 李榕, 陈迈, 等, 2012. 高胆固醇血症患者中不同分子量脂联素的分布及其与冠心病的相关性[J]. 心脏杂志, 24(4): 446-449. |
王文生, 2004. 四氢生物蝶呤抗心肌缺血再灌注损伤的实验研究[M]. 北京: 中国医科大学.
|
向萍霞, 2005. 肿瘤坏死因子α基因多态性与冠心病的相关性研究[M]. 武汉: 武汉大学.
|
熊一力, 邬堂春, 1995. 高温对大鼠热应激蛋白的影响[J]. 中华航空医学杂志, 6(4): 202-204. |
徐延光, 2005. 可溶性E-选择素和可溶性细胞间粘附分子与2型糖尿病及2型糖尿病合并下肢血管斑块形成病变的相关性研究[M]. 天津: 天津医科大学.
|
许遐祯, 郑有飞, 尹继福, 等, 2011. 南京市高温热浪特征及其对人体健康的影响[J]. 生态学杂志, 30(12): 2815-2820. |
薛艳军, 2008. TNF-α对EMs在位内膜体外培养细胞ICAM-1, sICAM-1及ICAM-1脱落率的影响[M]. 广州: 暨南大学.
|
杨军, 吴小庆, 薄小萍, 等, 2011. 血清中人热休克蛋白60的检测在急性冠状动脉综合征中的价值分析[J]. 现代医学, 39(1): 1-5. |
张宏, 方佩华, 赵伟, 等, 2004. 血清sICAM-1水平与高甘油三酯血症相关性探讨[J]. 全国首届代谢综合征的基础与临床专题学术会议论文汇编: 88-90. |
张华, 王峰, 陆伟, 等, 2005. 叶酸与四氢生物喋呤对高脂血症兔内皮功能的影响[J]. 实用医药杂志, 11(22): 997-999. |
张君怡, 2008. 1.老年人外周动脉狭窄与心脑血管事件的相关性研究; 2.细胞粘附分子与缺血性脑卒中的相关性研究[M]. 北京: 中国协和医科大学.
|
张书余, 马守存, 周骥, 等, 2013. 模拟寒潮对高血压疾病影响机理的实验研究[J]. 气象, 39(6): 830-835. |
张书余, 张夏琨, 谢静芳, 等, 2012. 白山市感冒与气象条件的关系分析和预报[J]. 气象, 38(6): 775-779. |
张夏琨, 周骥, 张书余, 等, 2014. 模拟寒潮对高血压疾病的影响实验研究[J]. 气象, 40(6): 784-788. |
张志辉, 周胜华, 祁述善, 等, 2006. 氧化应激, 炎症与冠心病患者冠状动脉斑块的关系[J]. 中南大学学报(医学版), 31(4): 556-558. |
赵爱华, 2011. 冠心病患者血清HIF-1α及HO-1水平的变化及其意义[J]. 当代医学, 17(9): 48. |
周桃, 夏豪.2007.缺氧诱导因子-1α与动脉粥样硬化易损斑块.心血管病学进展, 28(2):243-245.
|
周吴刚, 朱健, 周龙女, 等, 2007. 老年冠状动脉病变程度与血清热休克蛋白60的相关性研究[J]. 中华老年心脑血管病杂志, 9(7): 457-459. |
周亚峰, 刘志华, 程绪杰, 等, 2004. 肿瘤坏死因子对人血管内皮细胞凋亡的影响[J]. 苏州大学学报(医学版), 24(5): 620-623. |
Cramer T, Johnson R S. A, 2003. Novel role for the hypoxia inducible transcription factor HIF-1α[J]. Cell Cycle, 2(3): 192-193. |
Hirschl M M, Gwechenberger M, Binder T, et al, 1996. Assessment of myocardial injury by serum tumour necrosis factor alpha measurements in acute myocardial infarction[J]. European Heart Journal, 17(12): 1852-1859. DOI:10.1093/oxfordjournals.eurheartj.a014803 |
Kunst A E, Looman C W N, Mackenbach J P, 1993. Outdoor air temperature and mortality in the Netherlands: A time-series analysis[J]. American J Epidemiology, 137(3): 331-341. DOI:10.1093/oxfordjournals.aje.a116680 |
Luc G, Arveiler D, Evans A, et al, 2003. Circulating soluble adhesion molecules ICAM-1 and VCAM-1 and incident coronary heart disease: The PRIME Study[J]. Atherosclerosis, 170(1): 169-176. DOI:10.1016/S0021-9150(03)00280-6 |
Mandal K, Jahangiri M, Xu Q, 2004. Autoimmunity to heat shock proteins in atherosclerosis[J]. Autoimmunity Reviews, 3(2): 31-37. DOI:10.1016/S1568-9972(03)00088-0 |
Sluimer J C, Gasc J M, van Wanroij J L, et al, 2008. Hypoxia, hypoxia-inducible transcription factor, and macrophages in human atherosclerotic plaques are correlated with intraplaque angiogenesis[J]. Journal of the American College of Cardiology, 51(13): 1258-1265. DOI:10.1016/j.jacc.2007.12.025 |
Stamm C, Cowan D B, Friehs I, et al, 2001. Rapid endotoxin-induced alterations in myocardial calcium handling: Obligatory role of cardiac TNF-α[J]. Anesthesiology, 95(6): 1396-1405. DOI:10.1097/00000542-200112000-00019 |
Treinin M, Shliar J, Jiang H, et al, 2003. HIF-1 is required for heat acclimation in the nematode Caenorhabditis elegans[J]. Physiological Genomics, 14(1): 17-24. DOI:10.1152/physiolgenomics.00179.2002 |
Valgimigli M, Merli E, Malagutti P, et al, 2004. Hydroxyl radical generation, levels of tumor necrosis factor-alpha, and progression to heart failure after acute myocardial infarction[J]. Journal of the American College of Cardiology, 43(11): 2000-2008. DOI:10.1016/j.jacc.2004.01.036 |
Verma S, Maitland A, Weisel R D, et al, 2002. Novel cardioprotective effects of tetrahydrobiopterin after anoxia and reoxygenation: Identifying cellular targets for pharmacologic manipulation[J]. The Journal of Thoracic and Cardiovascular Surgery, 123(6): 1074-1083. DOI:10.1067/mtc.2002.121687 |
Wang Chunling, Zhang Shuyu, Ying Tian, et al, 2014. Effects of simulated heat waves on ApoE-/-Mice[J]. Int J Environ Res Public Health, 11(2): 1549-1556. DOI:10.3390/ijerph110201549 |
Zhang X, He M, Cheng L, et al, 2008. Elevated heat shock protein 60 levels are associated with higher risk of coronary heart disease in Chinese[J]. Circulation, 118(25): 2687-2693. DOI:10.1161/CIRCULATIONAHA.108.781856 |
 2015, Vol. 41
2015, Vol. 41 